
博华资本已投企业贝康医疗的“胚胎植入前染色体非整倍体检测试剂盒(半导体测序法)”(PGS)是国内首个,也是目前唯一一个获得医疗器械注册证批准上市(国械注准:20203400181)的产品。该证的获批标志着三代PGS检测正式进入有证时代,使我国摆脱了长久以来在三代试管临床应用领域无合规产品可用的窘境,也表明我国在辅助生殖规范应用监管层面的力度将不断加码。
在行业爆发前夕,加速辅助生殖行业重新洗牌,贝康医疗凭借独家获证的PGS注册产品,正式奠定了其在这一细分领域的龙头地位,成为一级市场基因检测领域最有潜力冲击上市的企业之一。
PGS的国家监管流程严格,无证产品将受严惩
从国家药品监督管理局了解到,我国2016年将PGS归为第三类医疗器械进行监督管理。三类医疗器械是最高级别的医疗器械,也是必须严格控制的医疗器械,生产需由国家药品监督管理局审查批准,并发放产品注册证书。PGS被界定为第三类医疗器械产品,这意味着任何在医院中使用的PGS产品必须达到国家三类医疗器械的标准,并获得三类医疗器械注册证,产品开发依托的平台也必须获得三类医疗器械注册证。
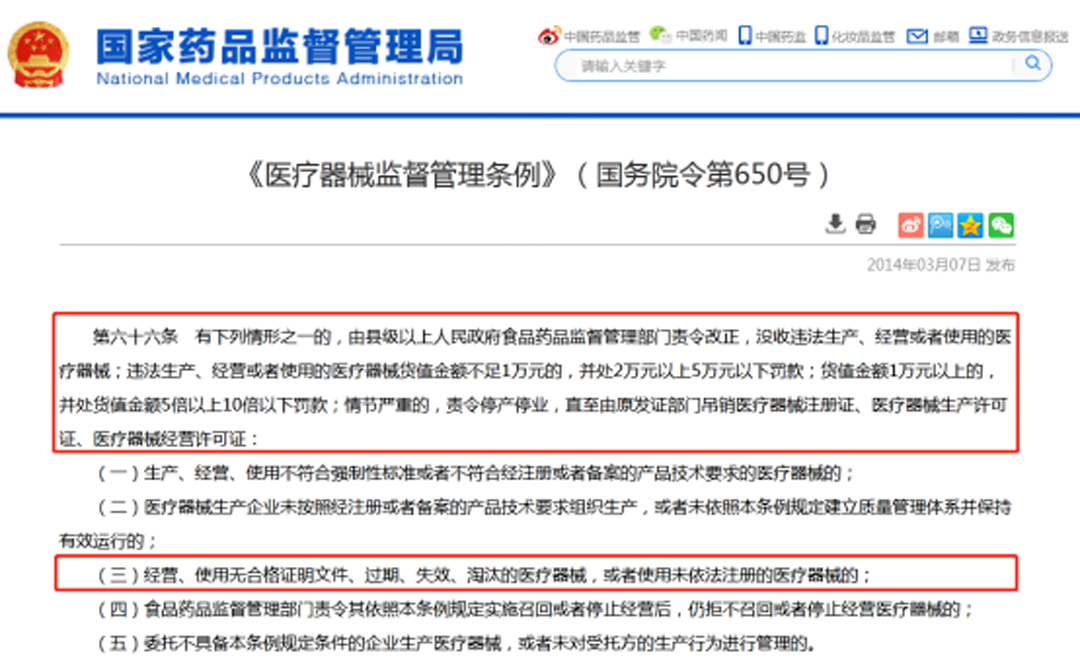
国家药品监督管理局发布的《关于印发医疗器械“五整治”专项行动方案的通知》中明确了使用无证产品的处罚依据,按照最新的《医疗器械管理条例》第六十六条规定,医疗机构使用未依法注册的医疗器械的,由县级以上人民政府药监局管理部门责令改正并没收违法使用的医疗器械,最高可处以货值金额10倍的罚款,情节严重的可责令停产停业。
贝康医疗PGS产品获证,突破此前临床应用无合规产品的窘境,引领三代试管婴儿正式进入合规化时代
由于此前三代试管临床应用领域合规产品的空白,各家机构PGS检测试剂盒主要采用科研试剂进行开展,质量良莠不齐、缺乏监管,患者纠纷事件屡屡发生。犹如2014年以前的无创产前基因检测(NIPT)市场,该产品上市前,同样经历过产品无证、试剂盒品牌层出不穷、临床应用门槛低、假阴性事件导致的出生缺陷频发的混乱时期。
2020年2月26日,国家药品监督管理局对外发布通告,批准了苏州贝康医疗器械有限公司(以下简称“贝康医疗”)生产的创新产品“胚胎植入前染色体非整倍体检测试剂盒(半导体测序法)”的注册申请。随着该产品的获批上市,意味着我国三代试管婴儿正式进入合规化、有证时代。
三代试管PGS临床应用合规监管力度将继续加强
上海市、广东省、湖南省、甘肃省、黑龙江省、内蒙古自治区、吉林省、贵州省、新疆维吾尔自治区等全国各省市、自治区的药品监督管理部门相继发布了该产品上市讯息,并表示后续将加强三代试管PGS产品及临床应用的监管力度,以切实保障辅助生殖中心患者用械安全。
在辅助生殖应用规范的严格监管体系下,未来我国的三代试管临床应用将不断走向成熟化、正规化和产业化发展的道路。
市场即将爆发,行业重新洗牌,贝康医疗有望成为业内最有潜力的上市企业
随着PGS合规化时代来临,市场正处于爆发前夕。据国家卫健委发布的数据显示,中国育龄夫妇的不孕不育率从20年前的近3%攀升到近年的15%,患者人数超过5000万,其中超过1000万的患者需借助辅助生殖技术实现生育。由于辅助生殖中心数量增加、辅助生殖治疗和三代试管技术渗透率提升、以及辅助生殖技术的不断进步,我国未来三代试管检测市场规模将超200亿人民币。
辅助生殖行业的洗牌加速,合规是必然趋势,也将是最大的门槛。贝康医疗历经4年多中心临床试验,累计完成了近万例胚胎样本的检测。临床数据统计显示,该PGS产品的应用能够将试管婴儿平均妊娠率提升至72%,流产率降低至6.9%,得到临床认可,于2020年2月正式获证,填补市场的空白,成为行业内唯一持证销售的合规产品,目前已与多个省市的大型医疗机构建立了30多个联合实验室,率先占据了近40%的市场。此外,2020年3月18日,贝康医疗与阳光财险达成战略合作,阳光财险将为使用贝康PGS产品的家庭提供40万元的商业保险,进一步拓展了贝康医疗的业务范围,建立起坚不可摧的护城河。
PGS产品注册证是继NIPT之后辅助生殖领域第二张基因检测高含金量的注册证。华大基因、贝瑞和康等生殖领域上市公司早期成功借助NIPT产业带来的利好进入快速发展期,华大基因上市后估值高达1000亿,贝瑞和康借壳上市后估值也达100亿。贝康医疗有望依靠其合规性优势享受新兴细分领域带来的高成长红利,一跃成为一级市场基因检测领域最有潜力冲击上市的企业之一。